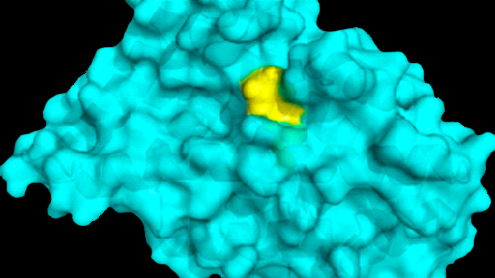
Los investigadores identificaron un objetivo oculto de la droga (amarillo) en una proteína neuronal (azul) que ha estado implicada durante mucho tiempo en la enfermedad de Parkinson pero que previamente fue considerada “no alcanzable” por los fármacos. Crédito: England Lab/UCSF.
Los secretos de una de las moléculas responsables del Parkinson
08 de marzo de 2019 | Comunicado de prensa original de la UC San Francisco.
Los investigadores de UC San Francisco han desarrollado por primera vez una estrategia para apuntarle a una molécula clave implicada en la enfermedad de Parkinson, abriendo una posible nueva estrategia de tratamiento para el trastorno de movimiento, que actualmente es incurable.
“Esta molécula es ampliamente considerada como uno de los principales objetivos terapéuticos para la enfermedad de Parkinson, pero esta es la primera evidencia convincente de que puede ser directamente drogada”, dijo Pamela England, PhD, profesora asociada de Química Farmacéutica en UCSF Escuela de Farmacia, y de Farmacología Celular y Molecular en la escuela de medicina de la UCSF, que fue la autora Senior del nuevo estudio, publicado el 7 de marzo de 2019, en Cell Chemical Biology.
La enfermedad de Parkinson afecta a 10 millones personas en todo el mundo con el empeoramiento progresivo de las dificultades del movimiento, así como los síntomas cognitivos y los relacionados con el estado de ánimo, todos los cuales son causados por la degeneración de las neuronas del cerebro medio que producen el neurotransmisor dopamina. Para la gran mayoría de los pacientes que sufren Parkinson, su enfermedad no tiene causas genéticas o ambientales obvias, y actualmente no hay ningún tratamiento para prevenir o retrasar la enfermedad. Los medicamentos existentes sólo aumentan temporalmente la señalización de la dopamina para suavizar los síntomas de la enfermedad, y puede conducir a efectos secundarios graves.
Durante la última década, investigaciones prometedoras han demostrado que antes de que las neuronas dopaminérgicas comiencen a degenerar, primero dejan de fabricar dopamina, lo que sugiere que los defectos en la vía molecular que produce y almacena la dopamina, puede ser uno de los culpables en la eventual muerte de las células. Uno de los principales sospechosos en esta cadena de eventos es el factor de transcripción Nurr1, una proteína que activa el gen que es crítica para la supervivencia de las neuronas dopaminérgicas y que también regula muchos aspectos de la producción y almacenamiento de la dopamina. La investigación en ratones modificados genéticamente ha encontrado que la escasez de Nurr1 puede conducir a síntomas similares a los de Parkinson, que pueden ser resueltos por elevar genéticamente los niveles de Nurr1.
Los investigadores han sospechado durante mucho tiempo que incrementar farmacológicamente los niveles de Nurr1 podría ralentizar o detener la progresión de la enfermedad de Parkinson en los seres humanos, y la Fundación Michael J. Fox, que apoya la investigación de Parkinson, lo ha señalado como uno de los objetivos terapéuticos principales. Sin embargo, después de más de una década de esfuerzos en este frente han fracasado. A diferencia de otros factores de transcripción, Nurr1 no tiene el “bolsillo” molecular estándar que los farmacólogos suelen buscar cuando diseñan nuevos fármacos. Esto lleva a algunos a suponer que nada se une naturalmente a Nurr1, lo que hace que la molécula sea “no alcanzable” por los fármacos.
Sin embargo, England y su equipo razonaron que para que Nurr1 sea capaz de realizar una de sus funciones claves -mantener los niveles adecuados de dopamina en las neuronas- la molécula debe ser capaz de detectar los niveles desequilibrados de dopamina y restaurar la homeostasis en el sistema basado en alguna señal química. Si los científicos pudieran identificar esta señal y replicarla con un fármaco, esto podría conducir a un nuevo enfoque "corriente arriba" que aumente los niveles de dopamina en pacientes con enfermedad de Parkinson y potencialmente prevenir el daño celular que desencadena la degeneración de las células dopaminérgicas.
A través de extensas pruebas, que incluyeron el modelado de la estructura Nurr1 a nivel atómico, el equipo de England demostró que una molécula llamada DHI, una sustancia producida cuando las células descartan el exceso de dopamina se une a un bolsillo de Nurr1, previamente insospechado. Otros experimentos mostraron que la adición de DHI a las células en los discos de laboratorio y en peces cebra vivos impulsan la actividad Nurr1, estimulando los genes involucrados en el almacenamiento y la producción de dopamina, exactamente lo que los farmacólogos han esperado lograr con una droga dirigida a Nurr1.
Mientras que DHI es demasiado inestable y reactivo para ser un candidato viable como fármaco, los autores sostienen que el descubrimiento de cómo se une a Nurr1, ha llevado a un valioso hallazgo para los científicos que esperan desarrollar fármacos que restauren el equilibrio dopaminérgico apropiado en pacientes que sufren la enfermedad de Parkinson y así, ralentizar la progresión de la enfermedad.
“Esperamos que estas ideas conduzcan a fármacos que por primera vez puedan atacar las causas subyacentes de la enfermedad de Parkinson", dijo England. “Pero en lo inmediato, este descubrimiento nos permite comprender mejor el papel de Nurr1 en las primeras etapas de la enfermedad. Como siempre, con la comprensión, viene la esperanza.”
Nota: Este artículo ha sido republicado a partir del material proporcionado por la UC San Francisco y editado para adecuar su longitud y contenido.
Referencia: Bruning, J. M., Wang, Y., Oltrabella, F., Tian, B., Kholodar, S. A., Liu, H., … England, P. M. (2019). Covalent Modification and Regulation of the Nuclear Receptor Nurr1 by a Dopamine Metabolite. Cell Chemical Biology, 0(0). https://doi.org/10.1016/j.chembiol.2019.02.002
Para más información, contactar a la fuente citada.
