Crédito: Universidad Rice
Procesamiento digital de señales ¡Ahora en las células vivas!
26 de abril de 2019 | Historia original de la Universidad Rice
Los biólogos sintéticos han añadido procesamiento señales analógico digital de alta precisión al circuito genético de las células vivas. La investigación, descripta on line en la revista Science, expande drásticamente los indicios químicos, físicos y ambientales que los ingenieros pueden usar para provocar respuestas programadas de organismos diseñados genéticamente.
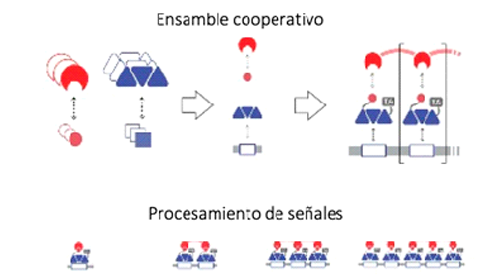
Usando un proceso bioquímico llamado ensamble cooperativo, Caleb Bashor de la Universidad Rice, Ahmad “Mo” Khalil de la Universidad de Boston (BU) y colegas del MIT, Harvard, el Instituto Broad y la Universidad Brandeis, diseñaron circuitos genéticos que permitieron tanto decodificar señales dependientes de la frecuencia como realizar filtrado dinámico de señales.
“Se puede pensar en la cooperatividad, como el mismo tipo de función de procesamiento de señal que le da un convertidor analógico - digital, un dispositivo que toma una señal básicamente lineal y la convierte en algo similar a un interruptor,” dijo Bashor, coautor líder del estudio y profesor asistente de Bioingeniería en la escuela de ingeniería Brown de Rice.
El ensamble cooperativo logrado por ingeniería sintética permitió a los investigadores realizar el tipo de procesamiento combinatorio de señales que las células hacen natural- y elegantemente para llevar a cabo tareas intrincadas, como las de desarrollo embrionario y la diferenciación celular.
“Este trabajo es un esfuerzo de biología sintética que aborda una cuestión importante tal cómo comprender cómo las células procesan la información a nivel del ADN”, dijo Tom Ellis, lector de Ingeniería de Genómica Sintética del Departamento de Bioingeniería del Imperial London College, que no estuvo involucrado en el estudio. "Es bien sabido que la naturaleza ha perfeccionado el procesamiento de información muy potente, con sólo un pequeño número de partes, pero desconvolucionando precisamente cómo funciona esto, lo que es virtualmente imposible en las células humanas debido a su complejidad. Recreando la forma en que las células humanas procesan la información a nivel de ADN, pero en un modelo simple de células de levadura con partes sintéticas, han sido capaces de recrear los primeros principios de la señalización compleja. Este es un excelente ejemplo de cómo el pensamiento como un ingeniero puede desbloquear una nueva forma de responder a las principales preguntas de la biología.”
En la naturaleza, las células a menudo tienen que tomar decisiones tipo blanco y negro basadas en información que es gris. Por ejemplo, imagínese que una célula tiene un gen que le permite sobrevivir en un ambiente altamente ácido, pero se necesita una buena cantidad de energía para activar ese gen y obtener la protección. A través de miles de millones de años de selección natural, las células que activan el gen demasiado temprano o demasiado tarde son superados por aquellos que hacen la decisión en el momento óptimo para asegurar la supervivencia y gastar la menor cantidad de energía.
“Ese tipo de precisión es una propiedad deseable para tener en circuitos sintéticos, también”, dijo Bashor, que se unió a la Universidad de Rice en 2018 y comenzó el proyecto varios años antes durante una temporada postdoctoral en BU. “La naturaleza a menudo lo hace a través de un proceso llamado auto ensamblaje cooperativo, en el cual varias proteínas denominadas factores de transcripción se ensamblan en un complejo más grande. Sólo cuando se juntan es lanzado el interruptor.”
Bashor, Khalil y sus colegas diseñaron un auto ensamblaje cooperativo inventando un sistema modular compuesto de proteínas sintéticas que se pueden ensamblar en complejos de tamaño variable. En este sistema, las celdas diseñadas se programan para producir componentes de ensamblaje en respuesta a cualquier entrada que los ingenieros deseen utilizar para activar el circuito. Por ejemplo, en sus experimentos, Bashor, Khalil y sus colegas programaron levaduras para responder a dos fármacos diferentes que se administraban en concentraciones variables a través de un dispositivo microfluídico.
De esta manera, la concentración de moléculas componentes producidas dentro de la levadura aumentó y cayó en respuesta a la entrada analógica -la concentración de fármacos en la cámara de ensayo-.
“Básicamente, estos componentes se unen entre sí con interacciones extremadamente débiles”, dijo Bashor. "Pero todas esas interacciones débiles se suman, en un complejo más grande, a algo que es realmente apretado. De este modo, cuando hay muy pocos de ellos flotando alrededor, no pueden formar el complejo, pero cuando alcanzan una concentración crítica, se encuentran mutuamente, y básicamente pueden reunirse y formar el complejo.”
La nitidez de una respuesta -o sea aquella que ocurre con rapidez, exactamente en el momento previsto- es clave para la precisión digital. Bashor y Khalil diseñaron complejos de activación que contenían desde tan solo dos componentes de factores de transcripción y hasta seis, y sus experimentos mostraron que cuanto mayor es el complejo, más nítida es la respuesta crítica.
“La ingeniería de este tipo de respuesta de los factores de transcripción fue fundamental para permitirnos programar células que realicen una variedad de funciones complejas diversa, como lógica booleana, filtrado dependiente del tiempo e incluso decodificación de frecuencia”, dijo Khalil, el autor de correspondencia del estudio.
Bashor dijo que la mayor parte del proyecto de cuatro años se dedicó a refinar un modelo predictivo que puede guiar a otros ingenieros en el uso de un sistema para diseñar convertidores analógico-digitales que puedan responder incluso a múltiples señales entrantes.
Para demostrar este aspecto del trabajo, el equipo diseñó y demostró circuitos de procesamiento de señales que recuerdan a la microelectrónica, que incluyen filtros pasa bajos que respondieron sólo a las entradas de medicamentos de baja frecuencia y a los filtros de tope de banda que se activaron sólo a altas frecuencias.
“Nuestro trabajo muestra cómo la no linealidad de los complejos de los factores de transcripción se puede utilizar para diseñar el procesamiento de señales en circuitos genéticos sintéticos, ampliando su funcionalidad y utilidad del mundo real”, dijo el biólogo sintético y coautor del estudio James Collins, quien tiene citas conjuntas en el MIT, Harvard y el Instituto Broad.
En el futuro, el laboratorio de Bashor planea utilizar el convertidor analógico - digital y otros circuitos genéticos sintéticos, para explorar y manipular los programas regulatorios que guían las funciones inmunes y de las células madre, con un ojo puesto en el desarrollo de terapéuticas basadas en células transformadas a partir de células humanas.
Este artículo ha sido republicado a partir del material proporcionado por a Universidad Rice y editado para adecuar su longitud y contenido.
Referencia: Bashor, C. J., Patel, N., Choubey, S., Beyzavi, A., Kondev, J., Collins, J. J., & Khalil, A. S. (2019). Complex signal processing in synthetic gene circuits using cooperative regulatory assemblies. Science, eaau8287. https://doi.org/10.1126/science.aau8287
Para más información, ver la fuente citada.
