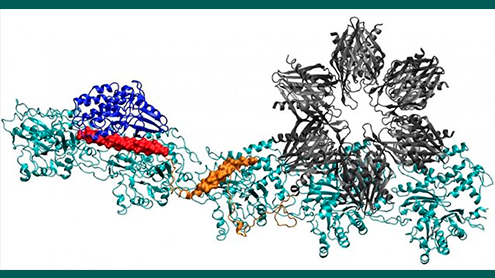
Un modelo de la proteína CaMKII muestra múltiples dominios que le permiten unir en bandas a los filamentos de actina de las dendritas de las neuronas, dándole a éstas su forma. Investigadores de la Universidad Rice, la Universidad de Houston y el Centro de Ciencias de la Salud de la Universidad de Texas, en Houston creen que el complejo es clave en la formación de la memoria a largo plazo. Crédito: Wolynes Research Lab/Rice University.
Explorando las moléculas de la memoria
27 de agosto de 2019 | Historia Original de la Rice University
Una nueva pieza de un difícil rompecabezas -la naturaleza de la memoria- cayó en su lugar esta semana con una pista de cómo las células cerebrales cambian de estructura cuando aprenden algo.
Las interacciones entre tres partes móviles -una proteína de unión, una proteína estructural y calcio- son parte del proceso por el cual las señales eléctricas entran en las neuronas y remodelan las estructuras moleculares que se cree que permiten la cognición y el almacenamiento de recuerdos.
Colegas de la Universidad Rice, la Universidad de Houston (UH) y el Centro de Ciencias de la Salud de la Universidad de Texas en Houston (UTHealth) combinaron teorías, simulaciones y experimentos para determinar cómo una proteína de unión central -dependiente de calcio- la calmodulina quinasa II (CaMKII)- se une y se desvincula del citoesqueleto de actina de una neurona.
El informe del equipo en el journal Proceedings of the National Academy of Sciences, da los primeros detalles claros de cómo actúan los sitios de unión de CaMKII para alinear los filamentos de actina -- la proteína estructural- en haces largos y rígidos. Los haces sirven como los esqueletos de soporte de espinas dendríticas, protuberancias puntiagudas que reciben mensajes químicos a través de sinapsis de otras neuronas.
Peter Wolynes, un físico teórico de Rice, se unió en una colaboración con la física de la UH, Margaret Cheung y el neurobiólogo de UTHealth Neal Waxham, para entender cómo las señales se abren camino a través de las dendritas, las ramas de las células nerviosas que transmiten la información entre las células.
Aunque se conocían las partes de su estructura, encontrar la estructura completa de CaMKII, ha demostrado ser un problema muy complejo para la cristalografía de rayos X. Cuando esta proteína se combina con la actina que compone el citoesqueleto, el sistema se configura en un complejo proteico aún más grande, que Wolynes y su equipo han analizado a través de su programa de predicción de estructura de proteínas, AWSEM.
Cuando se completó el estudio, la estructura predicha por computadora exhibió una coincidencia notable con las imágenes bidimensionales de microscopia electrónica realizadas por Waxham y su grupo que muestran claramente filamentos de actina paralelos que se mantienen unidos, como escaleras, por peldaños de CaMKII.
“Definitivamente hay pasos químicos preliminares que involucran la actividad enzimática de CaMKII previos a llegar a esta etapa; por lo tanto, no tenemos una imagen completamente clara de cómo armar todo”, dijo Wolynes. “Sin embargo, está claro que el montaje del complejo es el paso clave donde se convierte en una estructura a mayor escala, que puede contener una memoria”.
CaMKII es especialmente adecuada para interactuar con la actina, la proteína más abundante en las células eucariotas y una que tiene habilidades especiales en las neuronas, donde no sólo tiene que dar miles de dendritas (en cada uno de los miles de millones de neuronas) su estado de reposo, sino que también debe dar un nivel de plasticidad, que les permita adaptarse a un aluvión constante de señales.
Las moléculas de actina se autoensamblan en filamentos largos y retorcidos. Los bolsillos hidrófobos entre estas moléculas están perfectamente configurados para unir CaMKII, una proteína grande con múltiples partes o dominios. Estos dominios se bloquean en tres sitios de unión consecutivos en el filamento, y los giros colocan los sitios de unión a intervalos regulares para evitar que las proteínas se acumulen.
El dominio de “asociación” de CaMKII es una subunidad séxtuple que también se une a filamentos adyacentes para formar haces de actina, la columna vertebral de las espinas dendríticas que dan a estas protuberancias su forma.
Estos haces permanecen rígidos, si la dendrita contiene poco calcio. Pero cuando los iones de calcio entran a través de la sinapsis, se combinan con la calmodulina, lo que les permite unirse a otra región de la CaMKII, el dominio regulador flexible. Esto desencadena la disociación del dominio de CaMKII desde el filamento, seguido por el resto de la proteína, abriendo un breve período de tiempo durante el cual los haces pueden reconfigurarse.
“Cuando entra suficiente calcio, la calmodulina activada rompe estas estructuras, pero solo por un tiempo”, dijo Wolynes. “Luego se reforma el citoesqueleto. Durante ese tiempo, la columna dendrítica puede adoptar una forma diferente, pudiendo agrandarse”.
“Sabemos que el calcio trae información a la célula”, agregó Cheung. “Pero cómo las células nerviosas saben qué hacer con él, realmente depende de cómo esta proteína codifica la información. Una parte de nuestro trabajo es conectar eso a nivel molecular y luego proyectar cómo estas sencillas reglas geométricas desarrollan estructuras más grandes a microescala”.
Los cálculos del equipo mostraron que el dominio de asociación es responsable de aproximadamente el 40% de la fuerza de unión de la proteína a la actina. Un dominio conector agrega otro 40% y el dominio regulador crucial proporciona el 20% final, una estrategia sensata, ya que el dominio regulador está atento a las calcio-calmodulinas entrantes que pueden descomprimir toda la proteína del filamento.
El proyecto se realizó a través del Rice's Center for Theoretical Biological Physics (CTBP), del cual Wolynes es codirector y Cheung, científico senior. Su asociación se remonta a cuando ambos estaban en la Universidad de California, San Diego, él como profesor y ella como estudiante de posgrado del físico de Rice, José Onuchic, también codirector de CTBP.
Cheung conocía los trabajos previos de Wolynes y su grupo de Rice, que sugerían que la actina estabiliza las fibras, en forma similar a los priones que se cree que codifican los recuerdos en las neuronas. Por esta razón decidieron que era importante para su investigación unirse con Waxham para ver cómo el calcio activa CaMKII.
“Este es uno de los problemas más interesantes en neurociencia: ¿Cómo los cambios químicos a corto plazo conducen a algo a largo plazo, como la memoria?” señaló Waxham. “Creo que una de las contribuciones más interesantes que hacemos es capturar cómo el sistema toma cambios que ocurren en milisegundos a segundos y construye algo que puede sobrevivir a la señal inicial”.
El rompecabezas está lejos de estar completo, dijo Wolynes. "El trabajo anterior de Margaret y Neal se trató sobre el inicio de los eventos de la memoria", dijo sobre el estudio de sus colegas sobre la calmodulina. “Nuestro artículo sobre los priones se trató de la preservación de la memoria, al final del proceso de aprendizaje. Y el rol de la actina está en el medio de ambos. Aunque también puede haber muchas otras cosas en el medio.”
“Estas preguntas son interesantes para mucha gente”, dijo. “Este es un elemento clave del problema, pero claramente no es el final de la historia”.
Este artículo ha sido republicado a partir de los siguientes materiales y editado para adecuar su longitud y contenido. Para obtener más información, ver la fuente citada.
Referencia: https://www.pnas.org/content/early/2019/08/26/1911452116
