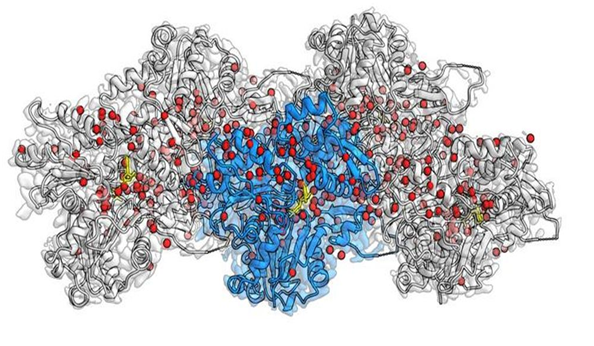
Reconstrucción por crio-EM de F-actina unida a Mg2+-ADP-BeF3. a una resolución de 2,2 Å. La subunidad central de actina es de color azul, las otras cuatro subunidades son grises. Las densidades correspondientes a las moléculas de agua son de color rojo y ADP en amarillo. Crédito: MPI de Fisiología Molecular
Los detalles más finos de los filamentos de actina revelados
27 de octubre de 2022| Historia original del Instituto Max Planck
Los filamentos de actina son fibras proteicas que forman parte del esqueleto interno de la célula. Como elementos activos de nuestras células, los filamentos de actina apoyan la fusión y el movimiento de la célula y están involucrados en muchos otros procesos celulares. Es importante destacar que también son un componente importante de las células musculares. La complejidad estructural de estos filamentos
ha fascinado a los científicos desde su descubrimiento en la década de los 40’, y ha abierto un mar de preguntas sin respuesta detrás de su capacidad para facilitar muchos procesos de la célula.
Por primera vez, los investigadores del Instituto Max Planck de Fisiología Molecular en Dortmund, Alemania, han podido visualizar con éxito cientos de moléculas de agua en el filamento de actina, lo que representa un salto cuántico en la investigación de actina. Utilizando la técnica de criomicroscopía electrónica (crio-EM), el grupo de Stefan Raunser revela con un detalle sin precedentes cómo las proteínas de actina se organizan sobre un filamento y cómo el ATP, la fuente de energía de la célula, se encuentra en el bolsillo de proteínas y dónde se posicionan las moléculas de agua individuales y reaccionan con ATP.
"Estamos respondiendo preguntas fundamentales de la vida que los científicos han estado tratando de responder durante varias décadas", señala Raunser. En las células eucariotas, las proteínas de actina son abundantes y tienden a unirse (polimerizarse) en filamentos. Estos filamentos forman la red que constituye el citoesqueleto de la célula y controla diversos procesos celulares a través del movimiento. Las células inmunes, por ejemplo, usan filamentos de actina para mover y cazar bacterias y virus. Los investigadores ya sabían que la dinámica de los filamentos está regulada por la hidrólisis de ATP, la reacción del ATP con agua que escinde un grupo fosfato y genera energía. Lo que anteriormente permanecía sin respuesta, sin embargo, eran los detalles moleculares exactos detrás de este proceso.
¿Demasiado flexible, demasiado grande? – no para la crio-EM
Como los filamentos de actina son demasiado flexibles y grandes para la cristalización de rayos X y la resonancia magnética nuclear, la crio-EM ha sido la única técnica viable para obtener imágenes detalladas. En 2015, el equipo de Raunser utilizó crio-EM para visualizar un nuevo modelo atómico tridimensional de los filamentos, con una resolución de 0,37 nanómetros. En 2018, su grupo describió los tres estados diferentes que adquieren las proteínas de actina en el filamento: unido a ATP, unido a ADP en presencia del fosfato escindido, unido a ADP después de la liberación del fosfato.
¿Cómo se mueven las moléculas de agua?
En su estudio actual, Raunser y sus colegas pudieron establecer un nuevo récord de resolución: obtuvieron los tres estados de actina con una resolución de aproximadamente 0,2 nanómetros, haciendo visibles detalles previamente invisibles. Los mapas tridimensionales no solo muestran todas las cadenas laterales de aminoácidos de las proteínas, sino que también revelan dónde se colocan cientos de moléculas de agua. A través de la comparación entre estas nuevas estructuras y las de actina aislada, pudieron inferir cómo se mueven las moléculas de agua. Tras la polimerización, las moléculas de agua se reubican en el bolsillo que aloja el ATP de tal manera que solo una molécula de agua permanece frente al ATP, lista para atacar un fosfato e iniciar la hidrólisis. La precisión obtenida a través de este enfoque puede ayudar a una mayor investigación en el campo: “Nuestro modelo de alta resolución puede impulsar a los científicos en el diseño de moléculas pequeñas para la investigación de microscopía óptica en tejidos y, en última instancia, en aplicaciones terapéuticas”, explica Raunser.
¿Un abridor de puertas?
Los autores también arrojan luz sobre el destino final del fosfato. Anteriormente, los científicos creían que había una puerta trasera en el bolsillo de ATP que permanece abierta después de la hidrólisis de ATP para facilitar la salida del fosfato. Sin embargo, las nuevas estructuras crio-EM no muestran rastro de puertas traseras abiertas. Por lo tanto, el mecanismo de liberación sigue siendo un misterio. “"Creemos que hay una puerta, pero es probable que se abra momentáneamente”, comenta Raunser, quien ahora quiere usar simulaciones matemáticas y métodos crio-EM resueltos en el tiempo para demostrar cómo sale el fosfato. Evidentemente, estos emocionantes descubrimientos han abierto la puerta para que los científicos profundicen con la esperanza de descubrir aún más detalles detrás de los procesos por los cuales los filamentos de actina contribuyen al movimiento de la célula.
Referencia
Oosterheert W, Klink BU, Belyy A, Pospich S, Raunser S. Structural basis of actin filament assembly and aging. Nature. 2022:1-6. doi: 10.1038/s41586-022-05241-8
Este artículo ha sido republicado a partir de los siguientes materiales. Nota: el material puede haber sido editado por su longitud y contenido. Para más información, ver la fuente citada.
